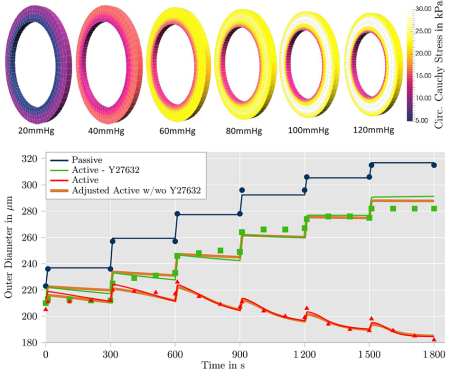
Abstract:
Contrary to striated muscle tissue, smooth muscle cells contract involuntarily to support the functionality of hollow organs such as the bladder or uterus, and protect the tissue from damage by overstretching. In the arterial wall, vascular smooth muscle cells are responsible for the adaptive reaction to changing blood pressure by which the blood vessels actively support the heart in providing sufficient blood supply for varying demands in the supplied tissues. To improve clinical practice in respect to medical and more invasive treatments of cardiovascular diseases, computational simulations of arterial walls in health and disease are considered a promising toolbox. A corresponding mechanical model has to be designed to describe two different stretch-dependent mechanisms which can be observed in smooth muscle cells: a calcium-dependent and a calcium-independent contraction. For the first one, stretch of the SMCs leads to an inlet of calcium ions which activates the myosin light chain kinase (MLCK). The increased activity of MLCK triggers the contractile units of the cells resulting in the contraction on a comparatively short time scale. For the calcium-independent contraction mechanism, stretch-dependent receptors of the cell membrane stimulate an intracellular reaction leading to an inhibition of the antagonist of MLCK, the myosin light chain phosphatase resulting in a contraction on a comparatively long time scale. The capturing of both contraction mechanisms in a chemo-mechanical model allows to describe the experimentally observed contraction of an artery as a reaction to increased internal pressure. This can be considered a crucial aspect of the regulatory mechanism of muscular arteries.
References:
DFG (German Research Foundation) project within the SPP(Priority Program) 2311 "Robust coupling of continuum-biomechanical in silico models to establish active biological system models for later use in clinical applications - Co-design of modeling, numerics and usability"
Cooperation with:
Prof. Dr. Axel Klawonn (University of Cologne)
Prof. Dr. Oliver Rheinbach (TU Bergakademie Freiberg)
Dr. Alexander Heinlein (TU Delft)
Abstract:
This project deals with the modeling of the pharmaco-mechanical interactions that occur in the vasculature. Pharmaceutical agents that directly influence the physical properties of arterial walls are routinely prescribed in the treatment of cardiovascular diseases such as hypertension and atherosclerosis. Understanding the behaviour of healthy and diseased arteries under the influence of drugs can help not only in optimizing treatment but also in the development of new drugs. As a part of this project, suitable models for complex pharmaco-mechanical processes such as drug-induced modifications of smooth muscle activation and remodeling of tissue composition are developed. A robust numerical framework for the solution of the resulting coupled fluid-structure-chemistry problems is developed. Domain decomposition based parallel solvers are used to solve large-scale patient specific problems.
References:
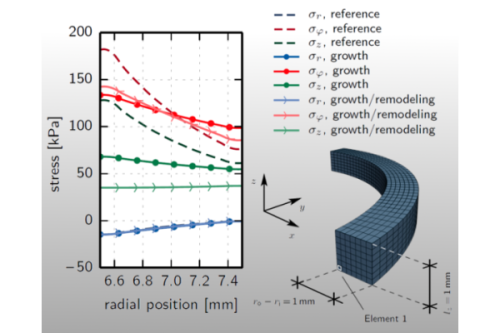
Übersicht:
Als lebende biologische Materialien können arterielle Gewebe ihr Lastabtragsverhalten verbessern, indem sie sich an Änderungen ihrer mechanobiologischen Umgebungsbedingungen anpassen.
So ist es beispielsweise bekannt, dass Arterien versuchen, einer andauernden Erhöhung des Blutdruckes durch Verdickung der Gefäßwand entgegenzuwirken.
Neben einer solchen Zunahme des gesamten Gewebevolumens, die durch den Begriff "Wachstum" erfasst wird, kann auch eine Neustrukturierung der vorhandenen Gewebekomponenten, ein sogenannter "Remodellierungsvorgang", als Reaktion auf geänderte Belastungssituationen auftreten.
Arterielle Gewebe sind mehrschichtige, heterogene Komposite, die als Matrixmaterialien mit eingebetteten Fasern verschiedener Orientierung idealisiert werden können.
Basierend auf dieser Vereinfachung kann eine entsprechend der lokalen Erfordernis eintretende Umorientierung der Fasern im Kontext der Remodellierungsvorgänge in Betracht gezogen werden.
Als Konsequenz arterieller Adaptionsprozesse, welche mit einer Reduktion von Verzerrungs- oder Spannungsspitzen und/oder -gradienten einhergehen, entstehen Eigenspannungen.
Diese im unbelasteten Zustand vorliegenden, mit sich selbst im Gleichgewicht stehenden Spannungen müssen bei der numerischen Simulation von Arterien berücksichtigt werden, da sie das Verhalten unter externer Last beeinflussen.
Die Modellierung arterieller Adaptionsprozesse erlaubt eine Abschätzung wachstumsinduzierter Eigenspannungen.
Weiterhin ermöglicht sie die Ermittlung einer mechanisch motivierten Näherung für die reale Verteilung der Fasern, welche eine weitere unbekannte Eingangsgröße bei numerischen Simulationen darstellt.
Referenzen:
DFG (Deutsche Forschungsgemeinschaft) project BA 2823/9-1, in cooperation with SNF (Swiss National Science Foundation) under the D-A-CH agreement
Cooperation with:
A. Klawonn (Universität zu Köln),
A. Quarteroni und S. Deparis (École polytechnique fédérale de Lausanne)
O. Rheinbach (Technische Universität Bergakademie Freiberg),
J. Schröder (Universität Duisburg-Essen)
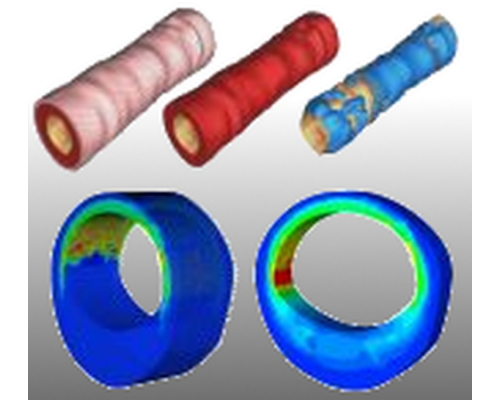
Abstract:
Transmural stress distributions of in vivo arteries are a major factor driving, e.g., the processes of arteriosclerosis and arteriogenesis. Realistic predictions for transmural stress distributions require a dynamic simulation considering the interaction of the blood flow with the vessel wall. One cannot expect to obtain precise predictions for vessel wall stresses using solid models that do not reflect the global layer structure and the anisotropic fibrous microstructure of the vessel wall. Furthermore, eigenstress distributions in the vessel wall must be taken into account for the analysis of more realistic stress regimes and can be observed to have significant influence on simulations. The fluid structure interaction (FSI) problem is known to be a nontrivial problem especially when nonlinear models are used for the structural part describing the deformation of the arterial wall. In this project, algorithms for the fluid structure interaction are developed based on domain decomposition methods and applied to the computation of realistic transmural stresses in physiological models of arterial walls. The associated systems of coupled nonlinear partial differential equations are to be solved in 3D and on different parallel machines. Moreover, a biologically motivated model for the incorporation of residual stresses is constructed based on nonlocal stress measures.
References:

DFG (Deutsche Forschungsgemeinschaft) project BA 2823/5-1, in cooperation with FWF (Austrian Science Fund) under the D-A-CH agreement
Cooperation with:
G. A. Holzapfel (Technische Universität Graz, Österreich)
Abstract:
This research project deals with the analysis and the modeling of traumatic degenerations of overstretched arterial walls that occur in therapeutical interventions. The data base for the qualitative and quantitative description of arterial tissues is obtained from biaxial extension tests performed on the tissue components of individual arterial layers loaded far beyond the physiological domain. Such tests enable the analysis of the macroscopic mechanical response of the tissues. In addition, structural analysis techniques such as Fourier transfer infrared spectroscopy and scanning electron microscopy are used to study damage on the smaller length scale. The macroscopic response of the fiber-reinforced tissues is described by a formulation based on micro-mechanical models characterizing the individual tissue components. These models take into account alterations of stochastic distributions of fiber properties as a consequence of the tissue overstretch. In order to obtain a quantitative prediction of the material response the model parameters are adjusted to the performed experiments based on least-square minimization. Finally, the models are validated by comparing finite element calculations with experiments performed on whole arterial wall segments.
References:
Kooperationspartner:
L. Perotti (University of Central Florida, USA)
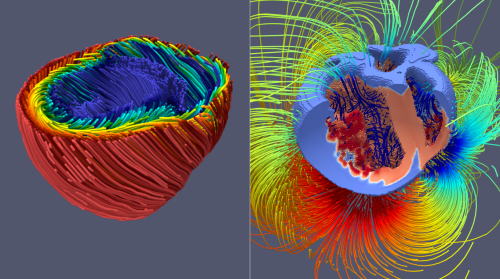
Abstrakt:
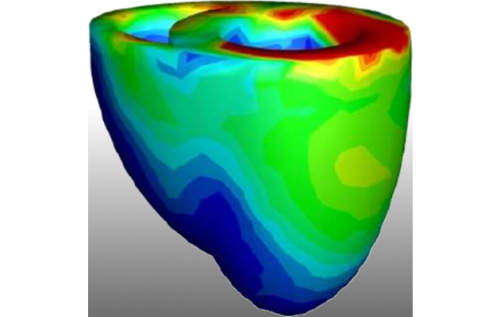
Herzsimulationen können ein vielseitig verwendbares Tool für die Forschung und personalisierte Medizin sein. Wir können beispielsweise virtuelle Gewebemodelle zur Untersuchung negativer und positiver Effekte von Medikamenten auf das Herz nutzen. Eine weitere interessante Anwendung ist die Untersuchung pathologischer Mechanismen hinter Herzerkrankungen wie der Herzinsuffizienz, da wir in Computersimulationen Details beobachten können die wir in Experimenten nicht messen können. Diese Modelle können auch sinnvolle Anwendungen in der Klinik finden, beispielsweise um erkrankte Geweberegionen zu lokalisieren und somit Kardiologen in Diagnostik und Therapie zu unterstützen.
Das Ziel dieses Projekts ist es drei Grundsteine auf dem Weg zu praktisch relevanten Herzsimulationen zu legen. Zuerst werden die involvierten mathematischen Modelle und die Implementierung der zugehörigen numerischen Simulation mithilfe von experimentellen Daten verifiziert und validiert. Dies versichert zu einem gewissen Grad, dass die Vorhersagen des Modells zumindest physiologisch plausibel sind. Unser Fokus ist hierbei auf elektromechanischen Modellen der beiden großen Herzkammern zusammen mit dem Herzleitungssystem, welche gegen klinisch relevante Größen wie das EKG validiert werden. Sobald ein gutes Modell hergeleitet wurde ist der nächste wichtige Schritt die Performance der Simulationen zu verbessern, da die meisten aktuelle Simulationsmethoden bekanntermaßen sehr langsam sind. Weiter ist die Konstruktion effizienter Simulationsmethoden auch inhärent wichtig im Translationsprozess zur Praxis, da viele Einrichtungen die aktuell benötigten Rechenressourcen und assoziierten Kosten nicht tragen können.
Referenzen:
Cooperation with:
L. Perotti (University of California Los Angeles, USA)
B. Klug (University of California Los Angeles, USA)
Abstract:
In order to improve diagnosis techniques to detect diseased tissues, particularly in important organs such as the heart, typically imaging-based methods are often applied. These enable a variety of information including geometry, deformation, distribution of electro-magnetic fields, etc. Based thereon, in this project a highly efficient method is developed to identify distributions of material properties within the heart as a solution of an improved reformulated inverse problem. An important focus is the guaranteed uniqueness of solutions to enable a reliable quantitative analysis.

Kooperationspartner:
Dr.-Ing. Mike Röllig (Fraunhofer-Institut für Keramische Technologien und Systeme IKTS),
Prof. Dr. rer. nat. habil. E. Spörl (Augenklinik, Universitätsklinikum Carl Gustav Carus an der Technischen Universität Dresden)
Abstrakt:
In diesem Forschungsprojekt sollen auf Basis numerischer Berechnungen Methoden zur Bestimmung biomechanischer Kenngrößen des menschlichen Auges hergeleitet werden. Diese Kenngrößen sind in der Augenheilkunde dreifach von Bedeutung.
Sie spiegeln pathologische Prozesse aufgrund biochemischer Veränderungen der Gewebestruktur wieder. Durch die Entwicklung einer Methode zur Messung der Kenngrößen, ermöglicht man eine frühzeitige Diagnose verschiedener Augenerkrankungen. Diese ist notwendig um Operationen am Auge zu vermeiden, da heutige nichtoperative Behandlungsverfahren nur das Fortschreiten der Erkrankung unterbrechen und den Ist-Zustand erhalten.
Weiterhin beeinflusst die Biomechanik der Gewebe die Abbildungseigenschaften und damit die Sehschärfe. Durch gezielte Veränderung der Biomechanik (z.B. durch Lasik) kann man diese Abbildungseigenschaften anpassen und dadurch Fehlsichtigkeit korrigieren. Bei bekannten patientenspezifischen biomechanischen Eigenschaften lässt sich die Korrektur besser planen und effizienter anwenden.
Auch Heilungsprozesse könnten durch regelmäßige Messung der biomechanischen Eigenschaften beobachtet werden.
Das Augenmerk der Arbeit liegt auf der numerischen Simulation der Systemantwort des menschlichen Auges während geeigneter medizinischer Untersuchungsmethoden. Mit Hilfe von Signifikanzanalysen werden verschiedene biomechanische Einflussfaktoren identifiziert und bewertet. Aus diesen wird dann ein mathematisches Modell zur Beschreibung des Augenverhaltens abgeleitet, mit dessen Hilfe zukünftig biomechanische Kennwerte invers ermittelt werden können.
Diese Aufgaben setzen eine realitätsnahe Definition äußerer Lasten, eine detaillierte geometrische Abbildung des menschlichen Auges und seiner Randbedingungen sowie die Herleitung geeigneter Materialmodelle der einzelnen Augenbestandteile voraus.
Cooperation with:
J. Guck (Biotechnology Center, Center for Molecular and Cellular Bioengineering, TU Dresden),
C. Werner(Leibniz-Institute for Biofunctional Polymer Materials Dresden)
Abstract:
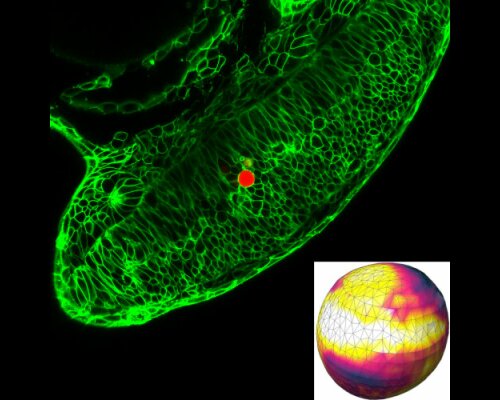
Mechanical stress exerted and experienced by cells during tissue morphogenesis and organ formation plays an important role in embryonic development. While techniques to quantify mechanical stresses in vitro are available, few methods exist for studying stresses in living organisms. In this project, hydrogel microbeads are injected into living tissue and imaged via fluorescence confocal microscopy. A method is developed to reconstruct the stress states of microbeads at different stages of the tissue development. In the long term, a more detailed understanding of the connection of cellular stresses and cell growth can be accomplished, supporting the diagnostics of developmental defects.